鋰硫電池電解液應選擇什么樣的氫氟醚
鉅大鋰電 | 點擊量:0次 | 2019年05月31日
研究背景
隨著鋰電池的大規模應用,發展可靠的電解液,并深入理解其機理顯得尤為重要。由于低的溶劑化特點,氫氟醚(HFEs)作為電解液共溶劑已經得到廣泛應用,其可增加電解液氧化還原穩定性、降低電解液黏度、構筑電解液局部濃度。同時,該電解液有助于抑制多硫化物的穿梭。盡管其應用領域寬泛,少量研究如氟原子的位置比其數量對短鏈(小于7個碳原子)HFEs的影響更為顯著等的報道,但是從分子內部結構去理解電化學性能非常欠缺。
成果簡介
近日,美國阿貢國家實驗室KhalilAmine教授(通訊作者)在AngewandteChemieInternationalEdition發表了題為“EstablishmentofSelectionRuleforHydrofluoroetherasElectrolyteCo-solventthroughLinearFree-EnergyRelationshipinLithium-SulfurBatteries”的論文。該論文第一作者是Chi-CheungSu。研究者借助內部參考擴散有序光譜(IR-DOSY),對HFE的擴散系數-配位比(D-α)進行計算,得到相對溶劑化能(γ)。據此,不同HFE溶劑中Li的溶解能以及溶劑與多硫化物穿梭動力學的線性自由能關系得以確立。結合電化學性能測試數據,研究者建立了根據吸電子氟代烷基的位置選擇HFE的規則。
圖文導讀
氫氟醚中氟代烷基可以在α,β或α和β'位。其中,α和β取代是氟烷基被限定在與氧原子最接近的位置,具有α氟烷基取代的氫氟醚在其β位置也可有氟烷基。根據氟烷基與氧原子的位置,HFE可分為三組。
A組包括1,1,2,2-四氟-3-(1,1,2,2-四氟乙氧基)丙烷(TTE)和1,1,2,2-四氟-1-(2,2,2-)三氟乙氧基乙烷(TFETFE),兩者都具有α-和β'-取代的氟烷基;
B組包括1-(1,1,2,2-四氟乙氧基)丙烷(TFEPE)和2-甲基-1-(1,1,2,2-四氟乙氧基)丙烷(TFEiBE),兩者均僅具有α-取代的氟烷基;
C組包括1,1,1-三氟-2-(2,2,2-三氟乙氧基)乙烷(BTFE),在α-,β-和β'具有取代的氟烷基。
IR-DOSY和D-α分析技術可以實現溶劑化狀態的定量測定,而相對溶劑化程度(γ)可以作為多硫化鋰(LiPS)穿梭效應的指標。本文,研究者采用IR-DOSY技術探測LiTFSI和DOL電解質中的HFE的溶劑化行為和γ值。
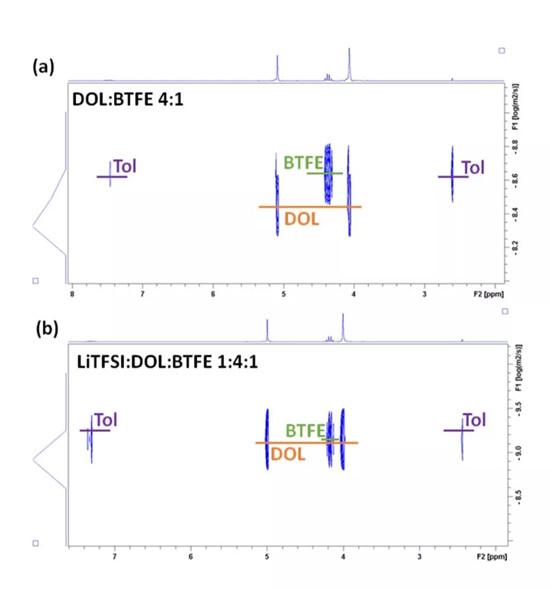
圖1(a)4:1DOL:BTFE和(b)1:4:1LiTFSI:DOL:BTFE電解液的1HDOSY-NMR譜
圖1a和1b分別表示的DOL:BTFE摩爾比為4:1和LiTFSI:DOL:BTFE摩爾比為1:4:1的DOSY光譜。數據表明,不加LiTFSI時,DOL擴散最快,而BTFE最慢;添加LiTFSI后,DOL的擴散系數降低最大,這意味著DOL會顯著的溶解鋰。通過比較兩者的擴散系數和配位數,結果顯示DOL對鋰的溶劑化能力高于BTFE。
表1不同電解質共溶劑的Li-S電池在850mAhg-1放電容量下的γ、CE和f值。
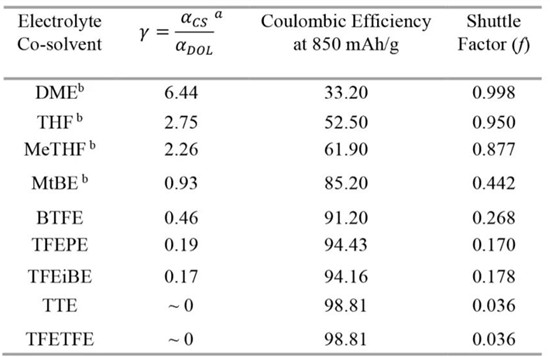
測量TFEPE和TFEiBE電解質的鋰擴散系數,配位比和配位數。結果表明所有三種電解質的配位數均約為2,A組的鋰離子溶劑化能力最低,B組HFE的配位比明顯小于C組。鋰離子主要通過DOL溶劑化,因此配位比越小則鋰的溶劑化能力越低。通過對比添加LiTFSI前后TTE和TFETFE的擴散系數比,A組HFE的擴散系數比表明其具有與甲苯相同的低鋰溶劑化能力。根據BTFE,TFEiBE和TFEPE的配位比,研究者計算了相應HFE的γ值,結果如表1所示,HFE的溶劑化能力顯著小于各種非氟醚。結果表明,在降低醚的鋰溶劑化能力方面,氟烷基強烈的吸電子效應可以勝過空間位阻效應。
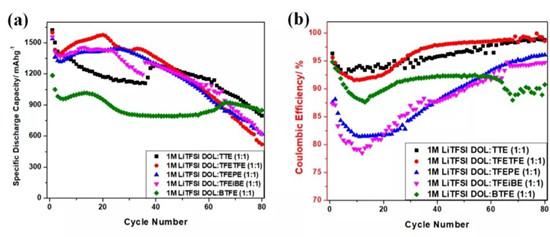
圖21.0MLiTFSI加1:1DOL:TTE,1:1DOL:TFETFE,1:1DOL:TFEPE,1:1DOL:TFEiBE和1:1DOL:BTFE電解質的Li-S電池的(a)容量保持率和(b)庫倫效率。
圖2a和2b分別為不同電解質的Li-S電池的容量保持率和庫侖效率(CE)。結果表明基于TTE-,TFETFE-,TFEPE-和TFEiBE的電池均顯示出高的初始比放電容量,基于BTFE的電池則顯示出更低的初始容量和更好的容量保持率。為評估LiPS的穿梭效應,采用實驗分別得到放電容量為850mAhg-1電池的CE和穿梭因子,結果如表1所示。在相同的放電容量下,HFE基電解質的f值遠小于常規醚。含有MtBE共溶劑電解質的穿梭因子顯著大于BTFE。這些結果再次證明了在醚共溶劑下,氟代烷基的吸電子效應可有效減輕LiPS溶解中的空間位阻。根據實驗得到的穿梭因子,HFE共溶劑可分為三組。BTFE(0.27)具有比TFEPE和TFEiBE(0.17)更大的f值,基于TTE和TFETFE(0.04)顯示出最低的f值。該劃分與基于氟烷基位置的分組相同。因此,A組HFE具有最低的鋰溶劑化能力和LiPS溶解能力,而C組HFE在所有三組中最高。
研究者還對不同HFE電解質進行電導率測試以探測離子運輸性。結果表明基于BTFE電解質的電導率最高,而TTE電解質的電導率最低。C組HFE電解質由于其相對高的鋰溶劑化能力和極性而表現出最高的電導率。由于非溶劑化性質,A組HFE電解質在減輕LiPS溶解方面效果最佳,但表現出最低的電導率。HFE電解質的電導率關系:C>B>A。因此,通常選擇C組HFE作為電解質的共溶劑。
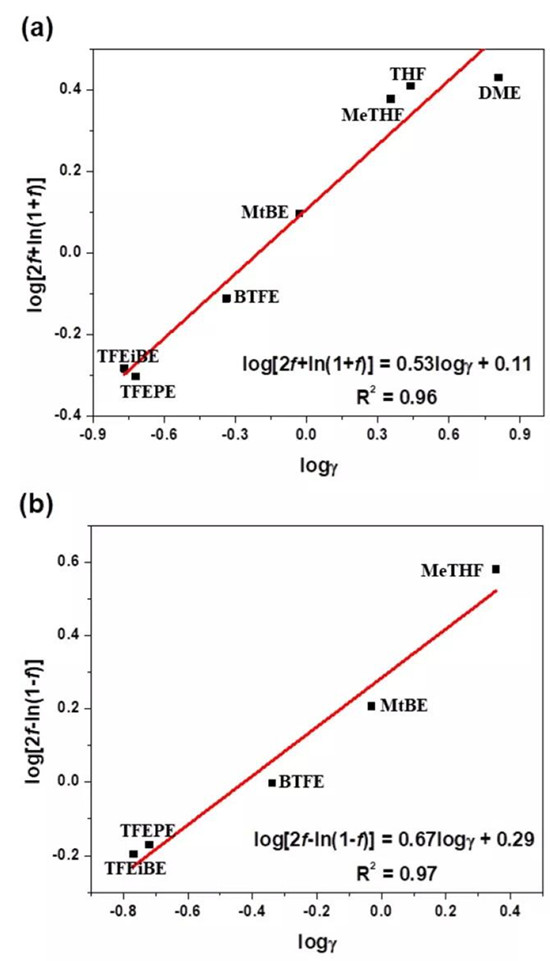
圖3(a)不同溶劑,放電容量為850mAhg-1的log[2f+ln(1+f)]與logγ關系曲線;
(b)不同溶劑,充電容量為1050mAhg-1的log[2f-ln(1-f)]與logγ關系曲線。
為評估電解質溶劑和LiPS副反應之間的定量構效關系(QSAR),研究者分別繪制了不同溶劑,放電容量為850mAhg-1的log[2f+ln(1+f)]與logγ關系曲線和充電容量為1050mAhg-1的log[2f-ln(1-f)]與logγ關系曲線,如圖3所示。這兩個線性關系證明了Li-S電池中電解質溶劑結構與LiPS穿梭之間存在線性自由能關系(LFER)。因而得到電解質溶劑的γ與LiPS穿梭效應之間的直接相關性。這是首次嘗試在電解質溶劑和鋰電池中的界面反應之間建立LFER關系。響應因子(ρ)在評估材料是否可以減少LiPS副反應方面非常有用。抑制LiPS副反應的越強,響應因子越低。高的相關系數表明LFER的可信度高,這種新方法不僅可以探測Li-S化學的機理,而且可以探測功能材料的效能。吸電子氟代烷基的位置決定了氫氟醚的鋰溶劑化能力,決定了LiPS溶解的程度。
結論
這項研究制定了具有普適性HFE的選擇規則。根據氟烷基與氧原子的相對位置,常用HFE可分為三組。由于α-和β'-取代的氟代烷基的存在,A組HFE顯示出最低的鋰溶劑化能力和最有效的抑制LiPS溶解的能力,C組與之相反。然而,C組HFE電解質具有最高的導電性,使得其更適合作為電解質的共溶劑。結果證明吸電子氟代烷基的位置會決定HFE性質。該發現不僅可以指導選擇合適的HFE助溶劑,而且為設計和合成新的功能性HFE提供方向。本文首次建立了電解質溶劑與Li-S電池界面反應之間的LFER。LFER參數可作為探討LiPS反應機理和驗證材料對緩解LiPS溶解的有效工具。
下一篇:有關電池研究中的電化學技術





































































